电话:15889676060
邮箱:bkmdserver@163.com
网址:http://www.bkmdkj.com

国家药品监督管理局2019年12月26日出台关于药品质量抽查检验工作的新规定,具体内容如下:
各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局,中国食品药品检定研究院:
为规范药品质量抽查检验工作,根据《国家药监局关于印发药品质量抽查检验管理办法的通知》(国药监药管〔2019〕34号)要求,国家药监局组织制定了《药品抽样原则及程序》以及《复验申请表》《复验申请回执》,现印发给你们,请遵照执行,省级药品监管部门可结合各自实际制定具体工作细则。
附件:1.药品抽样原则及程序
附件:2.复验申请表
附件:3.复验申请回执
|
药 品 封 签 |
任务类别/抽样编号: |
| 承检机构: | |
| 通用名及批号: | |
| 标示贮藏条件: | |
| 药品上市许可持有人: | |
| 抽样单位 / 经手人(签章)/电话: | |
| 被抽样单位/经手人(签章): | |
| 抽样封签日期: | |
| 此件封样数量: |
附3
药品抽样告知及反馈单
NO
| 抽样产品名称 | 抽样日期 | 年 月 日 | |
| 抽样单位名称 | |||
| 抽样人员姓名 | |||
| 对抽样单位抽样工作的评价 |
1.(□是 □否)抽样人员抽样前,是否出示有效证件(文件)? 2.(□是 □否)抽样人员是否对所抽取的样品当场进行封样,并对样品采取了防拆封措施? 3.(□是 □否)抽样人员是否按抽样样品说明书规定的贮存条件对所抽取的样品进行贮存? 4.(□是 □否)抽样人员在抽样过程中是否廉洁公正? 上述选项中填写“否”的,请简要描述抽样人员的违规行为(本处填写不下的,可另附书面说明): |
||
| (□是 □否)对抽样工作无异议,认同抽样工作符合法律法规要求。如勾选“是”,填写下面内容 | |||
|
被抽样单位 信息和印章 |
电话: E-Mail: 传真: 被抽样单位经手人签字: (加盖印章或指模) 填表日期: 年 月 日 |
||
附4
现场抽样的有关参考方法
1 现场抽样方法的确定
抽样批的确定:库存批数少于等于计划抽样批数时,各批均为抽样批;库存批数多于计划抽样批数时,应随机抽取。可参照简单随机或分层比例随机等方法确定抽样批。
简单随机方法:在抽取同一药品上市许可持有人生产的药品时,首先将药品批号进行编码,然后分别采取抽签、掷骰子、查阅随机数表或者用计算机发随机数等简单随机方法确定抽样批。
分层比例随机方法:如在抽取多个药品上市许可持有人生产的药品时,首先按药品上市许可持有人产品质量信誉的高低分为若干层次(例如可以分为A、B、C三层),然后按照质量信誉高的少抽、质量信誉低的多抽的原则,确定各层次药品上市许可持有人的抽样比例(例如1:2:3),确定各层次药品上市许可持有人的抽样批数,最后按简单随机抽样法确定抽样批。抽样人员可根据实际情况采用科学合理的分层随机方法。
2 抽样单元数(n)的确定
均质性和正常非均质性原料药、异常非均质性原料药和制剂抽样单元数的确定,可分别参照以下方法进行。
均质性和正常非均质性原料药:当一批药品的包装件数(N)不多于100件时,抽样单元数(n)按下表确定:
| N | 1 | 2~5 | 6~10 | 11~20 | 21~30 | 31~40 | 41~50 | 51~70 | 71~90 | 91~100 |
| n | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
当一批药品的包装件数(N)超过100件时,抽样单元数(n)按下式计算确定:n=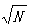 。
。
异常非均质性原料药:将该批原料药的各个包装件均作为抽样单元,即n = N。
制剂:计划抽取的样品数少于6个最小包装时,应当从相应数量的抽样单元中取样(如需抽取4个最小包装,应当从4个抽样单元中各取1个最小包装);计划抽取的样品等于或者多于6个最小包装时,则应当从6个抽样单元中抽样,并且从各单元中抽取的最小包装数应当大致相等(如须抽取12个最小包装,应当从6个抽样单元中各取2个最小包装单位)。
3 抽样单元的确定
3.1 抽样单元应随机抽取。可参照简单随机、系统随机或分段随机等方法确定。
简单随机方法:首先对各包装件编码,然后分别采取抽签、掷随机数骰子、查阅随机数表或者用计算器发随机数等简单随机方法,最后确定满足抽样单元数的具体抽样单元。
系统随机方法:首先将抽样批总体(即全部包装件数N)分成n个(即抽样单元数)部分,然后用简单随机方法从第一部分中确定某个包装件作为抽样单元,最后按相等间隔(N/ n)从每个部分中各抽取一个包装件作为抽样单元。
分段随机方法:大包装套小包装的一批药品的抽样单元的确定,应首先根据大包装的件数分别随机确定一级抽样单元数和一级抽样单元;然后根据一级抽样单元中较小包装的件数分别随机确定二级抽样单元数和二级抽样单元,以此类推,直至抽出最小包装的抽样单元。
3.2 异常非均质性原料药抽样量的确定
异常非均质性原料药应增加抽样量(Wi),增加的抽样量可参照下列公式确定:
Wi = P W
式中W为检验需求的样品总量,当包装件数(N)大于100件时,P值按下式计算:
P=0.4(N>100)
当包装件数小于等于100时,P值按下表确定:
| N | 1~10 | 11~40 | 41~80 | 81~100 |
| P | 1 | 2 | 3 | 4 |
附5
取样方法与最终样品的制作
1 取样方法
1.1 制剂取样方法
制剂以完整的最小包装作为取样对象,从确定的抽样单元内抽取单元样品。
1.2 原料药取样方法
原料药取样应当迅速完成,样品和被拆包的抽样单元应当尽快密封,以防止吸潮、风化、氧化或污染等因素影响药品质量。
固体半固体原料药取样方法:将抽样单元表面拭净后移至洁净取样室,用洁净干燥的抽样棒等适宜取样工具,从确定的抽样单元内抽取单元样品;一般应当从上、中、下、前、后、左、右等不同部位取样,但不一定从同一抽样单元的不同部位取样,而可在不同抽样单元的不同部位取样,满足样品的均衡性。取得的单元样品分别置于不同的洁净干燥的盛样器具中,并将品名、批号、抽样单元的编号标记于该器具上,并准确进行唯一性标识。n个抽样单元即有n个单元样品。
液体原料药取样方法:将抽样单元表面拭净后移至洁净取样室,先将液体充分混匀,再用洁净干燥的吸管等适宜工具从确定的抽样单元内抽取单元样品;有结晶析出的液体,应当在不影响药品质量的情况下,使结晶溶解并混匀后取样;一般应当采取从不同部位取样的操作方式满足样品的均衡性;抽取的不同抽样单元样品应分别置于不同的洁净干燥的盛样器具中,并准确进行唯一性标识。
1.3 特殊情形的取样方法
无菌原料药应当按照无菌操作法取样。
腐蚀性药品应当使用耐腐蚀的工具和容器。
规定避光的药品,取样和保存时应当采取避光措施。
需真空或充氮气保存的药品,应当使用专用设备、器材和容器,抽样后立即对样品和剩余药品进行密封处置。
2 最终样品的制作
2.1 原料药最终样品的制作
2.1.1 均质性与正常非均质性原料药最终样品的制作
当全部单元样本目视检查呈现均质性时,将其汇集、混匀,然后按1:0.5:0.5分为3份。
2.1.2 异常非均质性原料药最终样品的制作
当单元样品鉴别呈现正反应时,首先按外观性状一致性情况,分别将其汇集、混匀、缩分为不同的最终样品,然后将每个最终样品各按1:0.5:0.5分成3份。
当单元样品鉴别未呈正反应时,则应当将这些单元样品所属的抽样单元与其他抽样单元隔离,并加大抽样量,以便进一步检验确认。
2.2 制剂最终样品的制作
将单元样品汇集成最终样品,在保持最小包装完好的情况下,按1:0.5:0.5分成3份。
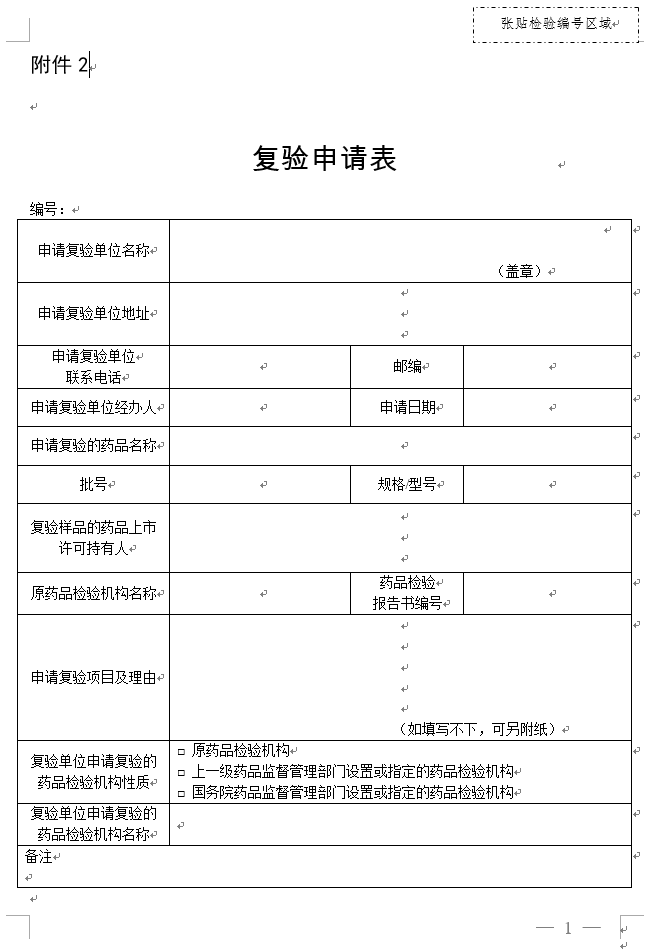
附件2
2.复验申请表
附件3
3.复验申请回执

电话:15889676060
邮箱:bkmdserver@163.com
网址:http://www.bkmdkj.com